在关键适应症上全面PK掉一款全球前十的畅销药是一种怎样的体验? 百济神州则向市场展示了:“完胜伊布替尼”,不是一句空话。 10月12日晚间,百济神州公布全球3期ALPINE试验的最新进展:研究显示,在复发或难治性(R/R)慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)成人患者中,经独立评审委员会和研究者评估,百悦泽®(泽布替尼)对 比伊布替尼,达到无进展生存期(PFS)的优效性结果。泽布替尼总体耐受性良好,本次分析显示的安全性结果与既往报告中一致。 由此,泽布替尼成为全球首个且唯一在CLL/ SLL中,“头对头”对 比伊布替尼,在PFS方面达到优效性的BTK抑制剂。 这是继今年4月公布ALPINE研究取得总缓解率(ORR)的优效性之后,对关键次要终点PFS优效性的确认。虽然目前PFS的具体数据尚未公布,但这已基本宣告了头对头ALPINE研究将圆满成功。
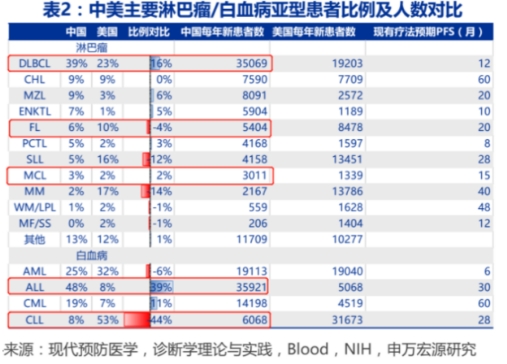
01.头对头“双优效”,奠定泽布替尼Best in class地位 这一结果,无疑奠定了泽布替尼在BTK抑制剂领域Best in class的地位。 目前,全球共有5款BTK抑制剂获批上市,分别为强生/艾伯维的伊布替尼、阿斯利康的阿卡替尼、百济神州的泽布替尼、吉利德的tirabrutinib和诺诚健华的奥布替尼,其中伊布替尼2021年销售额占据了全球BTK抑制剂领域接近75%的市场份额。 伊布替尼之所以能称霸市场,得益于其作为全球首款获批BTK抑制剂的先发优势,在独占市场的同时,很长一段时间保持绝对优势的市场份额。 作为已经上市近9年的一代BTK抑制剂,伊布替尼难免存在一定的不足。在一项真实世界的回顾性分析中,不少CLL患者存在关节痛、房颤、感染、感染性肺炎、出血和腹泻五大类的不良反应发生,导致部分患者无法真正从伊布替尼当中获益,而随着治疗时间的延长,心血管毒性的发生也在增加。 患者急需一个疗效更好、安全性更高的新一代BTK抑制剂。为了证明自家的泽布替尼优效于伊布替尼,百济神州选择了最硬核的一条道路:和伊布替尼正面“单挑”(头对头PK)。 目前,泽布替尼是全球唯一一款在针对两项血液恶性肿瘤的治疗中,开展头对头临床试验以评估疗效和安全性的BTK抑制剂,足以证明百济神州的信心和决心。 今年4月,百济神州宣布,经独立评审委员会评估,泽布替尼对 比伊布替尼显示了更具优势的ORR,结果分别为80.4%和72.9%(双侧p值=0.0264)。其中,ORR的定义为完全缓解(CR)和部分缓解(PR)数据的总和;在安全性方面,接受泽布替尼治疗的患者具有更低的心房颤动或扑动事件风险(4.6% vs 12.0%)。另外,泽布替尼组有13.0%患者因不良事件终止治疗,而伊布替尼治疗组则有17.6%患者因不良事件终止治疗。 对于癌症新药而言,全球业界考量其疗效的指标包括OS(总生存期)、PFS(无进展生存期)、ORR(总缓解率),其中对于慢性淋巴细胞白血病患者而言,通常比较重要的指标主要是PFS和ORR。 由于慢淋患者的疾病进展相对缓慢、治疗时间长,所以关注PFS指标对于评估患者长期的疗效和生存质量密切相关;而ORR的评估相对短期,主要考察在一定时间内,药物对肿瘤的影响和缓解情况。 向伊布替尼发起头对头挑战的,不止泽布替尼一个,阿斯利康的阿卡替尼同样在2021年1月公布了治疗CLL头对头ELEVATE-RR研究的结果:阿卡替尼在主要终点PFS方面仅是非劣于伊布替尼,另一关键次要终点显示阿卡替尼与伊布替尼相比,致使患者房颤不良反应发生率更低。 而泽布替尼治疗CLL的头对头临床ALPINE研究,则是先后在主要终点ORR、关键次要终点PFS都实现了优效性,两大核心数据的结合,足以让大量业界人士信服。 非劣和优效,一个是“我不比你差”,一个是“我比你强”,两者高下立判。 更重要的是,泽布替尼的成功有可能意味着市场将诞生一个新的“BTK药王”,更多淋巴瘤患者将因此而获益。 02.大适应症冲关在即,临床结果有望助力海外销售放量 毕竟是最高规格的药物PK,头对头固然要花费巨大的人力、物力、财力,但从前人经验来看,成功之后的回报往往也是可观的。 以强生的银屑病重磅药古塞奇尤单抗(IL-17单抗)为例,2019年古塞奇尤单抗在头对头司库奇尤单抗(2021销售额47.18亿美元)的III期试验中全面优胜,使其名声大噪。自此之后,古塞奇尤单抗市场销售再次加速,销售额从2018年的5.44亿美元迅速攀升至2020年的13.47亿美元,2021年销售额达到21.27亿美元,年复合增速超57%。 凭借海外市场的迅速拓展、差异化的产品优势和治疗潜力,泽布替尼近两年在海外产品销售有着显著加速的趋势。 2021年,泽布替尼在美国的销售收入获得大幅增长,收入达到7.46亿元,同比大增492.1%。 2022年上半年,泽布替尼实现全球销售额15.14亿元人民币,同比增长262.9%;其中在美国市场销售达到10.15亿人民币,同比增长504.5%,高于去年全年美国收入。 创新药放量不仅在于市场的认可,同时另一重因素在于适应症覆盖人群的扩大。 目前,泽布替尼在美国获批三项适应症,包括套细胞淋巴瘤(MCL)、华氏巨球蛋白血症(WM)、复发/难治性边缘区淋巴瘤(MZL),但实际上,这三项适应症在美国新发淋巴瘤患者中占比并不算太大,而美国血液瘤最大的细分适应症实际上是慢性淋巴细胞白血病(CLL)。
此前,FDA已经受理了泽布替尼用于治疗成人CLL/SLL的新适应症上市申请,根据PDUFA,做出决定的目标时间是2023年1月20日。 CLL是全球BTK竞争格局中最关键的适应症领域,如果未来泽布替尼的CLL/SLL适应症在美国顺利获批,其国际步伐将有望进一步加速。
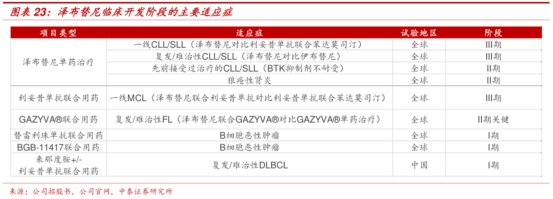
回望竞争对手阿卡替尼,亦是在CLL/SLL适应症获批后迅速放量(2019年获批),从2019年的1.64亿美元销售额提升至2021年的12.38亿美元。 对于上半年销售额不到2.5亿美元的泽布替尼来说,海外市场的放量才刚刚开始,毕竟伊布替尼在全球曾录得100亿美元的销售。 03.百济破内卷的法宝:全球临床能力、头对头、出海那些事 能够在海外闯出点名堂的泽布替尼,离不开一个强大而富有全球视野的创造者 —— 百济神州。 在泽布替尼之前,由于难度大、投入大、风险较高,国内少有企业直接发起全球性、头对头的优效性研究。 为什么没有?归结于胆识与眼界、资源、能力的多重障碍:1)早年国内大部分创新药企管线立项时以me-too为定位,对自身管线PK掉进口药物没有充分信心,同时对出海抱有太多未知的疑虑;2)三期临床本身花费占到药物管线研发成本的大头,如果开展头对头,不仅耗时长,可能让新药上市进程被延迟,且花费投入负担极大;3)全球性头对头临床往往旨在进军全球市场,需要强大的国际临床团队,从而在做好临床设计同时推动世界各地临床研究的进行。 头对头三期叠加全球多中心临床,对于当时充满太多未知的情况下,走出这一步不仅自身实力过硬,还需具备前瞻性的战略眼光。 仅仅泽布替尼ALPINE一项头对头试验,就先后在全球入组共652例患者,覆盖欧洲、美国、中国、新西兰和澳大利亚等多个国家和地区。 但这也只是泽布替尼在全球开展的25项临床试验之一,目前泽布替尼拥有广泛的临床项目,包括10项注册性或注册可用临床试验,入组了超过4500名受试者,其中超过3600例来自于中国以外。 看似轻描淡写的简单数字,却透视了百济神州背后的艰辛与优秀。 泽布替尼从2012年项目立项到当前海外市场开始放量,已经历了足足10年的时间。 并且,临床进展能够如此迅捷,离不开百济神州团队的实力与努力。百济神州神通过内部团队管理全球多区域临床试验,更快招募入组患者,从而能将临床开发环节的时间和成本降低三分之一。目前百济神州拥有一支超过2500名员工的全球开发和医学事务团队,在全球超过45个国家和地区执行近80项临床试验,入组了超过1.6万名受试者,其中一半入组受试者是在中国以外。 近年来,一家又一家的Biotech在FDA铩羽而归,代表着FDA正在提出更高的临床规范与标准,也劝退了部分心怀侥幸做me-too的药企。 未来可预见的是,百济神州泽布替尼的ALPINE试验这种“高标准、大规模、全球化”的头对头,或许将成为创新药企破除内卷竞争、检验研发实力的“金标准”。 结语:泽布替尼是百济神州完成从研发创新、商业化、再到生产全产业链布局的一个典型案例,随着这一能力持续被验证,公司正在加速成长为真正意义的全球性生物科技企业。 |